Como Obtener El Producto De Una Ecuacion Quimica
Estos son los posibles reactivos restantes en el producto después de la reacción es completa. 2 Busque los símbolos químicos que no están familiarizados con la tabla periódica.
Calculos En Las Reacciones Quimicas
Este cálculo te dará la cantidad en gramos de cada reactivo y producto químico que participa en la reacción.

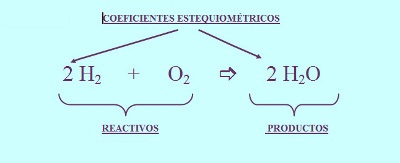
Como obtener el producto de una ecuacion quimica. Dentro de estos elementos se destaca que la ecuación debe corresponder a un proceso real debe seguir al pie de la letra la ley de conservación de la materia la ley de conservación de la energía y también la ley de conservación de la carga. Productos siempre se escriben en el lado derecho de una reacción incluso si es reversible. Estos son los reactivos.
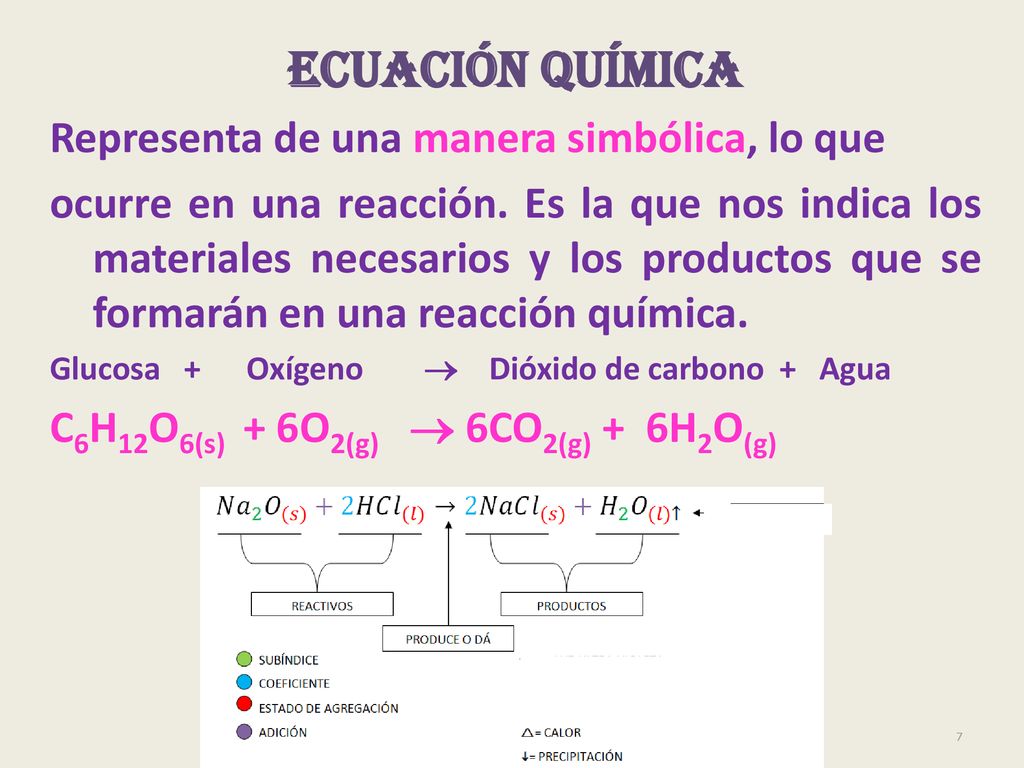
Las reacciones químicas convierten los reactivos en productos pero por lo general siempre quedan algunas cantidades de reactivos en los productos de la reacción. Qué cantidad de materia prima se debe usar para obtener una cantidad específica de producto. 2 6 O.
Paso 2 Paso 3 Paso 4 Ejercicio 2 Índice. Equivalente Químico de un Ácido. Porcentaje de rendimiento rendimiento real rendimiento teórico x 100.
Por lo tanto el producto de solubilidad Kps o PS es el producto de las concentraciones molares de los iones existentes en una solución saturada donde cada concentración es elevada a un exponente igual al respectivo. Una ecuación química es entonces la descripción breve que un químico hace de una reacción química. Los reactivos que permanecen sin usar en los productos disminuyen la pureza del rendimiento de la reacción.
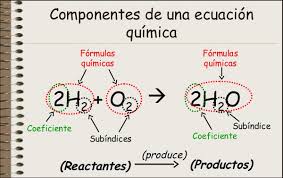
Debes considerar la escritura adecuada de las fórmulas y símbolos de todas las sustancias participantes. Los productos siempre se escriben en el lado derecho de una reacción incluso si es reversible. Productos en ecuaciones químicas Cuando una ecuación química está escrito los reactivos se enumeran en el lado izquierdo seguidos por la flecha de reacción y finalmente subproductos.
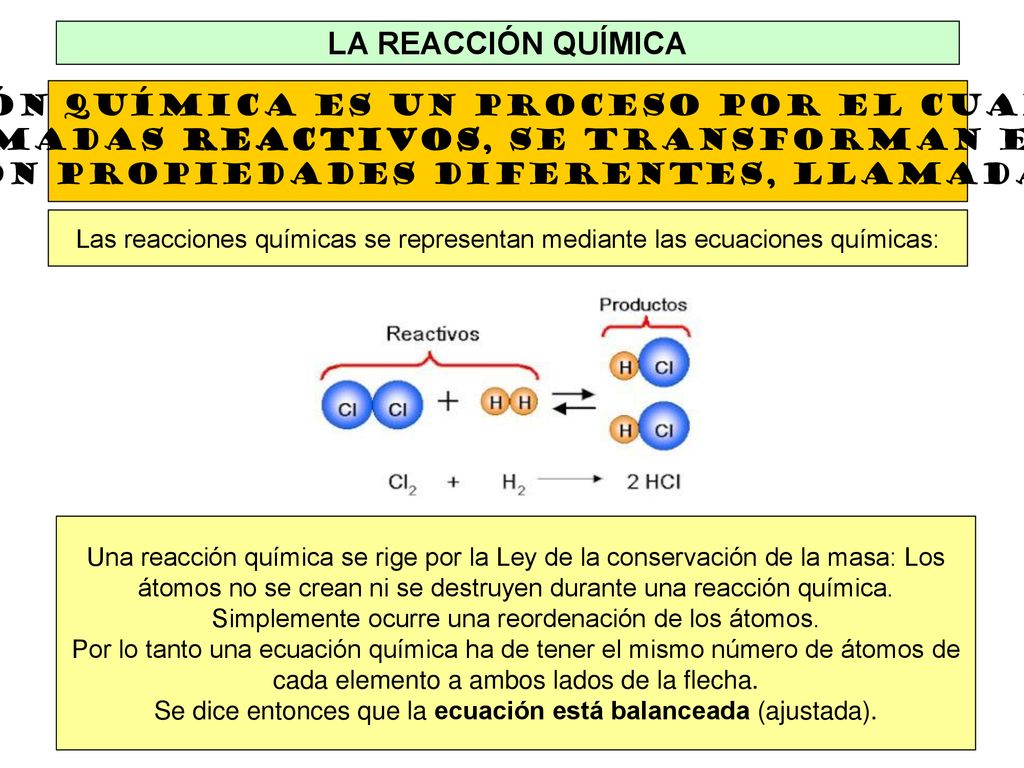
Por convenio en una ecuación química los reactivos se escriben a la izquierda y los productos a la derecha de la flecha. Fe2O3 H2O 2Fe OH3 Fe. 3 Comparación de los reactivos a los productos y asegúrese de que cada átomo individual se describe.
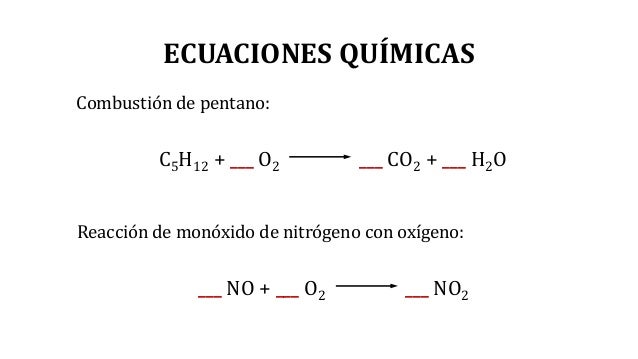
4 6 Pero los H y O siguen desbalanceados. Para realizar los cálculos estequiométricos es necesario disponer de la ecuación química ajustada de la reacción. Produciendo dos considerar como el inverso de las reacciones de combinación.
A B C D Donde A y B son reactivos y C y D son productos. 2 Calcular el peso molecular de todos los reactivos. - La ecuación para el rendimiento porcentual es.
Observa los subíndices junto a cada átomo para encontrar el número de átomos en la. Como la concentración de un sólido tiene valor constante el producto K i A 2 B 3 de la fórmula de arriba también es constante y se llama producto de solubilidad. En caso de que esta esté balanceada los coeficientes de cada producto te indicarán la cantidad que debes esperar en proporciones moleculares.
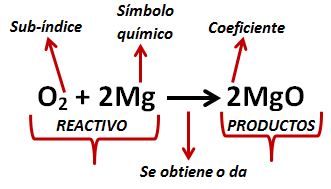
1 Enumerar los reactivos para la reacción química de interés. La ecuación química que describe la reacción entre el magnesio y el oxígeno es. En una ecuación química las sustancias que se combinan entre sí son los reactivos y se escriben a la izquierda.
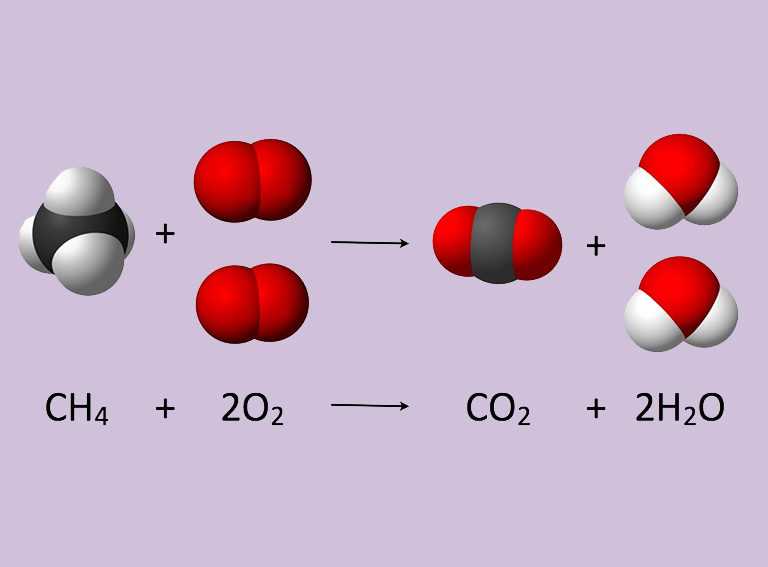
Sume el peso atómico de cada átomo en cada reactivo. Cuando se escribe una ecuación química los reactivos se enumeran en el lado izquierdo seguidos de la flecha de reacción y finalmente los subproductos. C3H8 O2 -- H2O CO2.
El método del mol sirve para conocer o dar respuesta a estas dos cuestiones y se basa en que los coeficientes de la reacción balanceada se interpretan como los moles de cada sustancia. Y son los que aceleran el proceso de la reacción química. B Análisis o descomposición una sola sustancia se descompone o se rompe o más sustancias distintas.
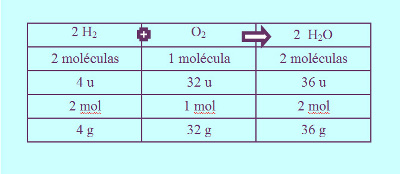
Por ejemplo con 2 moléculas de hidrógeno H 2 y 1 molécula de oxígeno O 2 se pueden obtener 2 moléculas de agua H 2 O. Un Equivalente Químico EQ también llamado Peso Equivalente o Equivalente-gramo es la cantidad de una sustancia que reacciona para producir 1 mol de producto. En la ecuación anterior el magnesio reacciona con el oxígeno para obtener óxido de magnesio.
Encuentra el producto deseado revisando la reacción. Un H2O aporta 2 H y nos faltan 4 H. Una ecuación química tendría la siguiente forma.
Los productos que se forman durante una reacción se encuentran al lado derecho de una ecuación química. Esta reacción ocurre cuando el propano C3H8 se quema en la presencia de oxígeno para producir agua y dióxido de carbonoStep 2 Anota el número de átomos por cada elemento que tengas a ambos lados de la ecuación. Para realizar el balance por inspección de una ecuación química debes de llevar a cabo los siguientes pasos.
Multiplicar los moles de cada reactivo y cada producto por el peso molecular para ese producto químico particular. Para este ejemplo usarás. A la derecha se escriben los productos que son las sustancias que se forman.
Paso 1 Escribe la ecuación con la estructura básica para la reacción. Si sabemos la masa. El rendimiento real es la cantidad de producto obtenido de una reacción química.
1 Mira la ecuación química y tomar nota de qué compuestos están inscritos en el lado izquierdo de la flecha. 2 Mg O2 2 MgO Reactantes Producto. Significado de las ecuaciones químicas.
Entonces podemos conocer la cantidad de moléculas de un producto que se puede obtener a partir de una cierta cantidad de moléculas de los reactivos. La ecuación quedará como. Por lo tanto sumaremos otros dos H2O para que tengamos tres H2O.
El material inicial a Reacciones de síntesis es aquella en dónde dos o más sustancias se unen para formar un nuevo producto. A b c d donde a y b son reactivos y c y d son productos. Indica la clase o calidad de las sustancias reaccionantes y productos.
Step 1 Anota la ecuación dada. Fe2O3 3H2O 2Fe OH3 Y. Los reactivos se separan de los productos por medio de una flecha su dirección es de reactivos productos.
Determinar qué elementos componen cada reactivo individual. Una ecuación química debe estar caracterizada por elementos en común para poder ser identificada como tal. Investiga la fórmula para determinar el porcentaje de rendimiento de la reacción química y calcúlalo.
Veamos cómo se calcula el Equivalente Químico en diferentes tipos de sustancias. Delante de los reactivos y productos se deben colocar coeficientes estequiométricos con el fin de que la cantidad de átomos en los reactivos sea igual a la cantidad de átomos en los productos y de esta manera cumplir con la ley de conservación de la materia. Determinar el rendimiento esperado de una reacción incluye determinar qué reactivo es el reactivo limitante para la ecuación.
En el ejemplo de arriba A y B serían los reactivos y C y D los productos. 2 2 H.

Ecuacion Quimica Portal Academico Del Cch

Significado De La Ecuacion Quimica Youtube

Quimica Balanceo De Ecuaciones

Balanceo De Una Reaccion Quimica
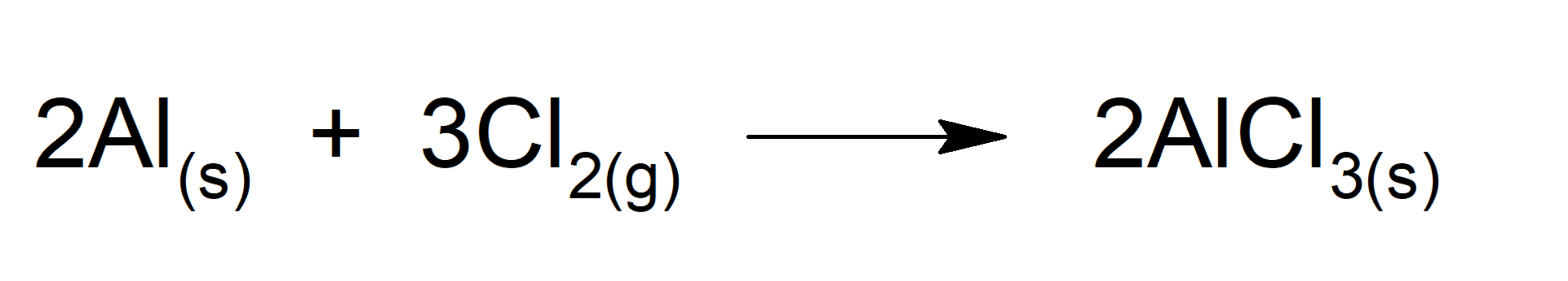
Producto En Quimica Concepto Proceso Y Rendimiento
Calculos En Las Reacciones Quimicas
Balanceo De Ecuaciones Quimicas Spanish Ged 365
Como Se Escribe Una Reaccion Quimica Clickmica
Como Saber El Producto De Una Reaccion Youtube
Tema 4 Reaccion Quimica Ppt Descargar
Reaccion Y Ecuacion Quimica Ppt Descargar

Ecuaciones Quimicas Reactivos Y Productos Coeficientes Y Subindices Youtube
Ecuacion Quimica Estequiometria Ppt Google Slides

Equilibrio De Ecuaciones Quimicas La Fisica Y Quimica

Ecuaciones Quimicas Reactivos Y Productos Coeficientes Y Subinidices Partes Y Simbologia Youtube






Post a Comment for "Como Obtener El Producto De Una Ecuacion Quimica"